- Modelos atómicos:
Desde la antigüedad el ser humano se ha cuestionado de que estaba hecha la materia.unos 400 años de cristo,el filosofo griego democrático considero que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras mas pequeñas.
Un modelo atómico es una representación estructural de un átomo que trata de explicar su comportamiento y propiedades.a lo largo del tiempo existieron varios modelos atómicos y algunos modelos mas elaborados que otros.
Modelo atómico de los griegos:

La palabra átomo fue nombrada por primera vez en Grecia cerca del año 500. a.C por los atomistas, siendo los más destacados Demócrito y su mentor Leucipo.
Desarrollaron la “teoría atómica del universo”, esta teoría afirmaba que todo lo percibido mediante los sentidos estaba formado por pequeñas partículas, invisibles,macizas, con diferentes formas y texturas, llamadas átomos.
Modelo atómico de dalton:
El modelo atomico de Dalton ;surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, propuesto entre 1803 y 1807.
Descubrimiento del electron
El 30 de abril de 1897, Joseph John Thomson (1856-1940) anunció el descubrimiento del electrón (aunque él no lo llamó así, lo llamó corpúsculo) en una conferencia impartida en la Royal Institution (Londres).
El electrón era una partícula más ligera que cualquier elemento conocido y constituyente de todos los átomos; lo que demostraba que estos no eran indivisibles. Este descubrimiento supuso uno de los hitos de la revolución de la ciencia de finales del siglo XIX que desembocó en una nueva concepción de la estructura de la materia y su interacción con la energía.
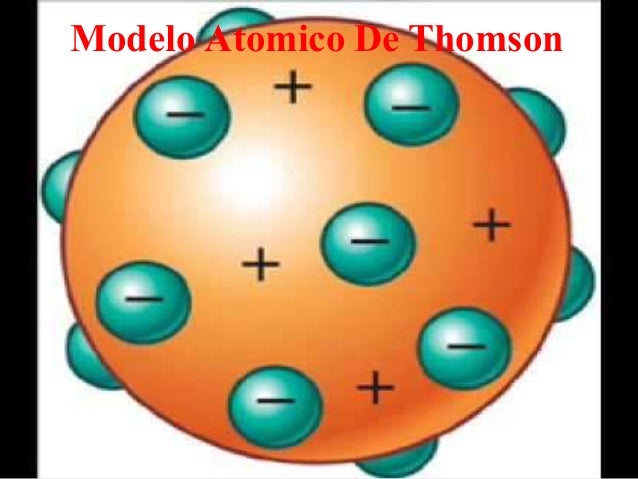
Modelo de thompson :
A principios de 1900 los químicos sabían que el átomo contenía partículas cargadas negativamente (electrones) y partículas positivas (protones), tan sólo quedaba por resolver la cuestión de cómo distribuirlas en el átomo.
- Thomson propuso un modelo atómico que consistía en distribuir de forma uniforme las partículas negativas dentro de una esfera cargada positiva mente. Este modelo fue denominado "budín de pasas", por el parecido que tiene con el famoso postre inglés.
El descubrimiento del proton y el neutron
Proton: es la partícula positiva del átomo, Se le acredita a Ernest Rutherford el descubrimiento del proton. en el año 1918 Rutherford encontró que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo muestran los signos de núcleos de hidrogeno.


núcleo: En 1909 fue reemplazado el modelo atómico de Thomson, por un antiguo alumno suyo, Ernest Rutherford, el cual descubrió que la gran parte de la masa del átomo, así como su carga positiva, se encontraba concentrada en el centro de su volumen total, prediciendo que dicha fracción se encontraba en el centro.
los experimentos llevados a cabo en 1911 bajo la dirección de Ernest Rutherford modificaron las ideas existentes sobre la naturaleza del átomo. Rutherford y sus colaboradores bombardearon una fina lamina de oro con partículas alfa (núcleos de helio)procedentes de un elemento radiactivo.
El modelo atómico que Rutherford
El modelo de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de
su "experimento de la lamina de oro" realizado en 1911.
su "experimento de la lamina de oro" realizado en 1911.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.

El modelo atómico de bohr
es un modelo clásico del átomo, pero fue el primer en el modelo atómico en el que se introduce una cuantizacion a partir de ciertos postulados. Dado que la cuantización del momento es introducida en forma ad hoc, el modelo puede considerarse transicional en cuanto a que se ubica entre la mecánica clásica y la cuántica. Fue propuesto en 1913 por el físico danés Niels Bohr , para explicar cómo los electrones pueden tener orbitas estables alrededor del nucleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905